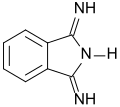
1,3-Diiminoisoindolin
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | 1,3-Diiminoisoindolin | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C8H7N3 | ||||||||||||||||||
| Kurzbeschreibung | |||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 145,16 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest | ||||||||||||||||||
| Dichte | |||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Löslichkeit | |||||||||||||||||||
| Brechungsindex |
1,5400 (25 °C, 589 nm)[3] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). Brechungsindex: Na-D-Linie, 20 °C | |||||||||||||||||||
1,3-Diiminoisoindolin DII ist ein Isoindol- bzw. Isoindolinderivat, das in 1- und 3-Stellung mit einer Iminogruppe substituiert ist. DII ist eine wichtige Vorstufe für außerordentlich lichtstabile blaue und grüne Pigmente aus der Stoffklasse der Phthalocyanine. Die Verbindung ist auch als Modellverbindung für Porphyrine, Chelate und Pigmente, sowie für Pharmawirkstoffe von Interesse.
Historie
[Bearbeiten | Quelltext bearbeiten]Die Grundlagen der Chemie des 1,3-Diiminoisoindolenins wurden von Reginald Patrick Linstead und Mitarbeitern am Imperial College London[5] und von Forschern der Bayer AG[6][7], damals Farbenfabriken Bayer, in den 1950er Jahren erarbeitet.
Darstellung
[Bearbeiten | Quelltext bearbeiten]Das große, insbesondere industrielle, Interesse an Phthalocyaninen hat zur Entwicklung einer Vielzahl von 1,3-Diiminoisoindolenin-Synthesen geführt, die von Phthalsäure (1,2-Benzoldicarbonsäure) und ihren Derivaten, wie z. B. Phthalodinitril, Phthalsäureanhydrid, Phthalimid oder Phthalsäuremono- bzw. -diamid ausgehen.[7]
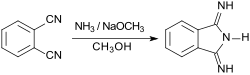
Phthalsäure bzw. ihre Derivate werden in Substanz oder in hochsiedenden Lösungsmitteln, wie z. B. Nitrobenzol, mit Stickstofflieferanten wie Harnstoff und Ammoniumnitrat NH4NO3 sowie katalytischen Mengen von Diammoniumdimolybdat (NH4)2Mo2O7 erhitzt, wobei 1,3-Diiminoisoindolin in hohen Ausbeuten (> 80 %) gebildet wird.[2] Die Labormethode mit Phthalodinitril und gasförmigem Ammoniak in Methanol mit geringen Mengen Natriummethanolat bei Raumtemperatur (70 % Ausbeute) erfordert keine Molybdänsalze.[8]
Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Die Diiminostruktur des Isoindol-1,3-diimins steht im Gleichgewicht mit der Amino-iminostruktur des 1-Amino-3-iminoisoindolins.

Im festen Zustand liegt 1,3-Diiminoisoindolin in der Aminoform vor. Aus heißer Benzollösung erhaltene Kristalle enthalten ausschließlich die syn-Form.
1,3-Diiminoisoindolin ist ein farbloser bzw. hellgelber kristalliner Feststoff, der in langen farblosen Nadeln als Hydrat kristallisiert. Die wasserfreie Substanz löst sich wenig in Wasser, aber gut in Methanol, Ethanol und Aceton. Salze des 1,3-Diiminoindolins sind als Nitrat, Phosphat, Sulfit und Perchlorat schwerlöslich in Wasser. In Säuren, wie z. B. Salzsäure oder Essigsäure bilden sich wasserlösliche Chloride bzw. Acetate, in verdünnten Alkalihydroxiden die leicht löslichen Alkalisalze.[7]
Bei Erwärmen in wässriger Lösung hydrolysiert DII über Monoiminophthalimid zu Phthalimid.

Beim Schmelzen gibt 1,3-Diiminoisoindolenin Ammoniak NH3 ab und bildet gefärbte Kondensationsprodukte. DII wird als zum Niesen reizende und bitter schmeckende Substanz beschrieben.[7]
Anwendungen
[Bearbeiten | Quelltext bearbeiten]1,3-Diiminoisoindolin reagiert mit überschüssigem Hydrazin N2H4 unter Ringerweiterung zu dem substituierten Diazin bzw. Diazanaphthalin 1,4-Dihydrazinophthalazin.[9]

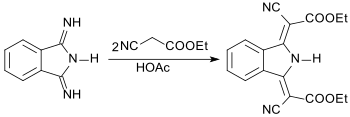
Mit CH-aciden Verbindungen, wie z. B. Cyanessigsäureethylester, kann DII zu gelben, orangen oder roten Pigmenten kondensiert werden.[10]
Mit 2-Aminopyridin bildet 1,3-Diiminoisoindolin 1,3-Bis(2-pyridinylimino)isoindolin BPI, das wie eine molekulare Pinzette Schwermetallionen wie z. B. Nickel Ni2+ umfassen kann.[5]

Bei der Reaktion von DII mit aromatischen Diaminen wie 1,3-Diaminobenzol oder 2,6-Diaminopyridin entstehen phthalocyaninanaloge so genannte Hemiporphyrazine, bei denen eine oder zwei Isoindolineinheiten durch aromatische Ringe ersetzt sind.

Hemiporphyrazine weisen ein hochkonjugiertes, planares, aber nicht-aromatisches 20π-Elektronensystem auf und sind gute Chelatoren und Chromophore.[11] Sie sind thermisch sehr stabil und unempfindlich gegenüber Sauerstoff, allerdings nicht gegenüber wässrigen Säuren.[12]
Wichtigste Anwendung für 1,3-Diiminoisoindolin ist als Ausgangsstoff für Phthalocyanine, die durch Kondensation von vier DII-Molekülen zu einem porphyrinartigen, planaren und nach der Hückel-Regel mit [4n+2] = 18 π-Elektronen aromatischen Ringsystem. Phthalocyanine bilden stabile Komplexe mit Übergangsmetallionen, von denen Kupferphthalocyanin als Blaupigment die größte Verbreitung gefunden hat.[13]

Ihre außergewöhnlichen chemischen, photochemischen, optischen und thermischen Eigenschaften machen Phthalocyanine zu vielseitig verwendbaren Materialien für innovative Anwendungen[14], wie z. B. als Absorber in farbstoffsensibilisierten Solarzellen, Energiespeichermedien, chemische Sensoren, NLO-Materialien, in Quantenpunkten (engl. quantum dots) und als Photosensibilisator in der Phototherapie von Tumoren.[15]
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b c d Datenblatt 1,3-Diiminoisoindoline bei Sigma-Aldrich, abgerufen am 29. September 2020 (PDF).
- ↑ a b c Patent US2727048: 1-Amino-3-imino-isoindolenines. Angemeldet am 21. August 1950, veröffentlicht am 13. Dezember 1955, Anmelder: Farbenfabriken Bayer AG, Erfinder: G. Rösch, W. Wolf, H. Vollmann.
- ↑ a b Carl L. Yaws: Thermophysical Properties of Chemicals and Hydrocarbons, 2nd Edition. Elsevier Inc., Oxford, UK 2015, ISBN 978-0-323-28659-6, S. 187.
- ↑ Eintrag zu 1,3-Diiminoisoindoline bei TCI Europe, abgerufen am 30. Dezember 2020.
- ↑ a b J.A. Elvidge, R.P. Linstead: 975. Heterocyclic imines. Part I. Imino-derivatives of isoindoline and their reaction with primary bases. In: J. Chem. Soc. 1952, S. 5000–5007, doi:10.1039/JR9520005000.
- ↑ Patent DE879100: Verfahren zur Herstellung und Isolierung von neuen Zwischenprodukten der Phthalocyaninsynthese. Angemeldet am 25. August 1949, veröffentlicht am 24. August 1950, Anmelder: Farbenfabriken Bayer, Erfinder: G. Rösch, W. Wolf, H. Vollmann.
- ↑ a b c d F. Baumann, B. Bienert, G. Rösch, H. Vollmann, W. Wolf: Isoindolenine als Zwischenprodukte der Phthalocyanin-Synthese. In: Angew. Chem. Band 68, Nr. 4, 1956, S. 133–150, doi:10.1002/ange.19560680402.
- ↑ I.-S. Tamgho, J.T. Engle, C.J. Ziegler: The syntheses and structures of bis(alkylimino)isoindolines. In: Tetrahedron Lett. Band 54, Nr. 46, 2013, S. 6114–6117, doi:10.1016/j.tetlet.2013.08.134.
- ↑ Patent US2786839: Dihydrazinodiazine derivatives. Angemeldet am 30. Juni 1954, veröffentlicht am 26. März 1957, Anmelder: Cassella Farbwerke Mainkur AG, Erfinder: W. Zerweck, W. Kunze.
- ↑ Y.V. Zatsikha, B.R. Schrage, J. Meyer, V.N. Nemykin, C.J. Ziegler: 1,3-Diylideneisoindolines: Synthesis, structure, redox and optical properties. In: J. Org. Chem. Band 84, 2019, S. 6217–6222, doi:10.1021/acs.joc.9b00468.
- ↑ F. Fernandos-Lázaro, T. Torres, B. Hauschel, M. Hanack: Hemiporphyrazines as Targets for the Preparation of Molecular Materials: Synthesis and Physical Properties. In: Chem. Rev. Band 98, Nr. 2, 1998, S. 563–576, doi:10.1021/cr970002a.
- ↑ J.A. Elvidge, R.P. Linstead: 976. Conjugated macrocycles. Part XXIV. A new type of cross-conjugated macrocycle, related to the azaporphyrins. In: J. Chem. Soc. 1952, S. 5008–5012, doi:10.1039/JR9520005008.
- ↑ Patent DE2136767A: Verfahren zur Herstellung von Kupfer-Phthalocyaninpigmenten. Angemeldet am 27. Januar 1972, veröffentlicht am 22. Juli 1971, Anmelder: Sumitomo Chemical Co., Ltd., Erfinder: T. Akamatsu, T. Ashiya, T. Yasuo.
- ↑ D. Gounden, N. Nombona, W.E. van Zyl: Recent advances in phthalocyanines for chemical sensor, non-linear optics (NLO) and energy storage applications. In: Coord. Chem. Rev. Band 420, 2020, S. 213359, doi:10.1016/j.ccr.2020.213359.
- ↑ P.-C. Lo, M.S. Rodriguez-Morgade, R.K. Pandey, D.K.P. Ng, T. Torres, F. Dumoulin: The unique features and promises of phthalocyanines as advanced photosensitizers for photodynamic therapy of cancer. In: Chem. Soc. Rev. Band 49, Nr. 4, 2020, S. 1041–1056, doi:10.1039/C9CS00129H.

