ACE-Hemmer
ACE-Hemmer sind Arzneistoffe, die insbesondere in der Therapie des Bluthochdruckes (Hypertonie) und der chronischen Herzinsuffizienz Anwendung finden. Sie sind Hemmstoffe (Inhibitoren) des Angiotensin konvertierenden Enzyms (Angiotensin Converting Enzym = ACE), das Teil einer blutdruckregulierenden Kaskade ist (Renin-Angiotensin-Aldosteron-System). Chemisch leiten sie sich von ACE-hemmenden Inhaltsstoffen aus Schlangengiften ab.
Die wichtigsten in der Therapie verwendete Vertreter sind Captopril, Enalapril, Lisinopril und Ramipril. Diese zählen auch auf Grund ihrer großen therapeutischen Bedeutung zu den umsatzstärksten Arzneistoffen überhaupt.
Chemie

ACE-Hemmer, wie Captopril, Enalapril und ihre Nachfolgersubtanzen sind strukturverwandt mit dem aus dem Schlangengift der brasilianischen Jararaca-Lanzenotter (Bothrops jararaca) isolierten Peptid BPP5a (von "Bradykinin-potenzierendes Peptid"; siehe Abbildung). Die in BPP5a vorkommende und aus drei Aminosäuren bestehende Tripeptidsequenz Tryptophan-Alanin-Prolin wurde als wirksame Komponente erkannt (in Abbildung rot dargestellt).
Da BPP5a und das Tripeptid im Körper sehr schnell abgebaut werden, wurden zahlreiche Modifikationen am Molekül vorgenommen, um die Wirkdauer zu verlängern. Dazu wurde die Tryptophan-Alanin-Prolin-Sequenz gegen eine ähnliche aber stabilere Phenylalanin-Alanin-Prolin-Sequenz ausgetauscht. Die Einbringung einer bernsteinsäure- oder glutarsäureanalogen Struktur (in Abbildung grün dargestellt) brachte weitere Stabilität und eine Verstärkung der Hemmwirkung am Angiotensin Converting Enzym.
Darüber hinaus sind bis auf Captopril und Lisinopril alle therapeutisch genutzten ACE-Hemmer Prodrugs, die erst im Körper aktiviert werden. Im Falle von Enalapril geschieht dies durch Abspaltung der Ethylgruppe durch Esterasen, wodurch die Wirkform, das Enalaprilat, mit einer freien Carboxylgruppe entsteht.
Pharmakologie
Anwendungsgebiete
ACE-Hemmer werden überwiegend zur Therapie des Bluthochdrucks eingesetzt. Hierfür gelten sie einzeln (Monotherapie) und in Kombination mit anderen Blutdrucksenkern (Kombinationstherapie, insbesondere mit Diuretika oder Kalziumkanalblockern) als Mittel der ersten Wahl. Bei Bluthochdruckformen, die mit einem erniedrigten Renin-Spiegel im Blutplasma einhergehen (z.B. Conn-Syndrom) zeigen ACE-Hemmer hingegen nur unzureichende Wirksamkeit.
Daneben haben sich ACE-Hemmer in zahlreichen großen klinischen Studien auch bei der chronischen Herzinsuffizienz als deutlich lebensverlängernd erwiesen. Dies beruht wahrscheinlich auf der Senkung der Nachlast und Abnahme der Wandspannung des Herzmuskels durch die Abnahme von Angiotensin II.
Auch nach Herzinfarkten haben sich ACE-Hemmer als Mittel der Wahl durchgesetzt. Hier stehen neben der Erweiterung der Blutgefäße vor allem Effekte auf das Zellwachstum Vordergrund.
Ein weiteres Anwendungsgebiet (Indikation) der ACE-Hemmer ist die diabetische Nephropathie. Derzeit besitzt lediglich Captopril eine Zulassung für diese Indikation.
Wirkmechanismus
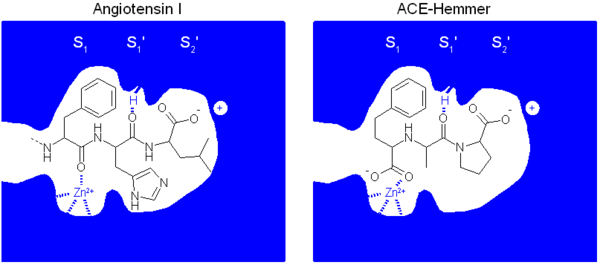
Der Wirkungsmechanismus der ACE-Hemmer beruht in einer Hemmung des Angiotensin Converting Enzyms. Dieses Enzym hat im Organismus zwei Hauptaufgaben. Einerseits ist es für die Synthese des vasokonstriktorisch wirksamen Octapeptids (Peptid aus 8 Aminosäuren) Angiotensin II aus seiner inaktiven Vorstufe, dem Decapeptid (10 Aminosäuren) Angiotensin I unter Abspaltung der zwei C-terminalen Aminosäuren zuständig. Andererseits katalysiert es den Abbau des Mediators Bradykinin in inaktive Produkte.
Die Hemmung des Angiotensin Converting Enzyms hat eine Abnahme der Angiotensin-II-Konzentration an den Angiotensinrezeptoren (AT1 und AT2) zur Folge. Primär sinkt dadurch der Blutgefäßtonus und der Blutdrucks nimmt ab. Sekundär führt die Abnahme des Angiotensin-II-Spiegels zu einer Verringerung der Aldosteron-Freisetzung aus der Nebennierenrinde und somit zu einer Beeinflussung des Wasserhaushalts (siehe auch Renin-Angiotensin-Aldosteron-System). Auf zellulärer Ebene kann ein Rückgang der durch Angiotensin II vermittelten mitogenen Effekte an Fibroblasten und Myozyten des Herzens, die insbesondere nach einem Herzinfarkt zu ungünstgen Veränderungen (Remodeling) führen, beobachtet werden.
Die Hemmung des Abbaus von Bradykinin führt hingegen zu dessen Kumulation und damit verbundenen Nebenwirkungen.
Molekularer Wirkmechanismus
Auch der molekulare Wirkmechanismus der ACE-Hemmer konnte aufgeklärt werden. Er beruht auf der Ähnlichkeit der ACE-Hemmer zu einem Peptitkettenende des Angiotensin I. Dadurch werden ACE-Hemmer vom Angiotensin Converting Enzym fälschlich für das physiologische Substrat Angiotensin I gehalten. Im Gegensatz zum physiologischen Substrat werden sie aber nicht vom Enzym umgesetzt und blockieren dieses.
Pharmakokinetik
Entsprechend ihrer chemischen Differenzen unterscheiden sich die ACE-Hemmer auch untereinander in der Pharmakokinetik. Die Mehrzahl der derzeit verfügbaren ACE-Hemmer sind Prodrugs. Das heißt dass sie nach einer 20%igen (Ramipril) bis fast 100%igen Aufnahme (Resorption) durch Enzyme im Körper aktiviert werden müssen (siehe Chemie). Lediglich Captopril und Lisinopril benötigen diesen Aktivierungschritt nicht. Maximale Plasmaspiegel der Wirkformen werden nach 1 bis 8 Stunden erreicht. Die Plasmahalbwertzeiten schwanken zwischen 2 (Captopril) und 40 Stunden (Spirapril). Entsprechend variiert auch die Wirkdauer (8 bis 48 Stunden). Alle ACE-Hemmer werden überwiegend über die Niere ausgeschieden. Fosinopril, Moexipril und Spirapril zeigen darüber hinaus eine relevante biliäre Exkretion (Ausscheidung über die Galle).
Nebenwirkungen
Die meisten Nebenwirkungen von ACE-Hemmern werden mit einem verlangsamten Abbau und Kumulation von Bradykinin durch ACE-Hemmer in Verbindung gebracht. Dazu zählen Hautreaktionen, wie z.B. Exantheme (0,1 - 1%) und Nesselsucht (0,01 - 0,1%). Schwere allergische Hautreaktionen werden hingegen nur sehr selten beobachtet (< 0,01%). Die als charakteristisch für ACE-Hemmer geltende Nebenwirkung, das Auftreten angioneurotischer Ödeme, kann ebenfalls nur selten beobachtet werden (0,01 -0,1%).
Auch die Mehrzahl der die Atemwege betreffenden Nebenwirkungen kann mit einer Kumulation von Bradykinin in Verbindung gebracht werden. Dazu zählen trockener Husten, Heiserkeit und Halsschmerz (0,1 - 1%). Asthmaanfälle und Atemnot können ebenfalls, wenn auch selten, auftreten (0,01 - 0,1%).
Unter der Therapie mit ACE-Hemmern kann es bradykininunabhängig zu einer zu starken Bludrucksenkung kommen. In Folge dessen können gelegentlich Schwindel, Kopfschmerz und Benommenheit beobachtet werden (0,1 - 1%). Von schweren Herz-Kreislaufereignissen, wie Angina pectoris, Herzinfarkt und Synkope, wurde nur in Einzelfällen berichtet.
Durch Eingriff in den Wasser- und Elektrolyhaushalt können gelegentlich funktionelle Nierenfunktionsstörungen beobachtet werden (0,1 - 1%). Eine Proteinurie (Ausscheidung von Protinen im Harn) wurde hingegen nur selten beobachtet (0,01 - 0,1%).
Da ACE-Hemmer in der Schwangerschaft u.a. Wachstums- und Knochenbildungsstörungen beim Kind verbunden mit einer erhöhten Sterblichkeit hervorrufen können, dürfen ACE-Hemmer in dieser Zeit nicht eingenommen werden und sollten durch andere geeignete therapeutische Maßnahmen ersetzt werden.
Wechselwirkungen
ACE-Hemmer verstärken die blutbildverändernden Nebenwirkungen immunsuppressiv wirkender Arzneistoffe (Immunsuppressiva, Zytostatika und Glucocorticoid). Ebenso verstärken ACE-Hemmer die blutzuckersenkende Wirkung oraler Antidiabetika und Insulin.
Durch Eingriff in den Wasser- und Elektrolythaushalt kann die Ausscheidung von Lithium verlangsamt werden. Ebenso kann eine Verstärkung der Anstiegs des Kaliumspiegels bei kombinierter Anwendung mit kaliumsparenden Diuretika beobachtet werden.
Bei Kombination mit anderen blutdrucksenkenden Arzneimitteln sollte eine verstärkte Blutdrucksenkung berücksichtigt werden. Synergistische Effekte, die auch therapeutisch ausgenutzt werden, treten insbesondere mit Diuretika und mit Kalziumkanalhemmern auf. Eine verringerte blutdrucksenkende Wirkung der ACE-Hemmer konnte vereinzelt nach Einnahme kochsalzreicher Kost beobachtet werden.
Arzneistoffe
Derzeit sind in Deutschland folgende ACE-Hemmer als Arzneistoff zugelassen:
- Benazapril
- Captopril
- Cilazapril
- Enalapril
- Fosinopril
- Imidapril
- Lisinopril
- Moexipril
- Perindopril
- Quinapril
- Ramipril
- Spirapril
- Trandolapril
Geschichte
Der Grundstein für die Entwicklung der ACE-Hemmer wurde 1956 mit der Aufklärung der Funktion des Angiotensin Converting Enzyms (ACE) durch Leonard T. Skeggs gelegt. Die Bedeutung dieses Enzyms für die Blutdruckregulation wurde anfangs noch unterschätzt.
14 Jahre nach der Entdeckung des Angiotensin Converting Enzyms (1970) wurde durch den Pharmakologen Sergio H. Ferreira herausgefunden, dass das Gift der Jararaca-Lanzenotter in-vitro zu einer Hemmung dieses Enzyms führt. Mit dem in diesem Schlangengift enthaltenen Pentapeptid BPP5a wurde sogleich eine der wirksamen Komponenten isoliert.
Da BPP5a im Körper sehr instabil ist, startete fast gleichzeitig eine Suche nach potenteren und stabileren Inhibitoren des Enzyms. Ein erster Erfolg gelang 1971 mit der Entdeckung der ACE-hemmenden Wirkung des Nonapeptids Teprotid. Die klinische Weiterentwicklung von Teprotid wurde jedoch zwei Jahre später aus mangelndem kommerziellen Interesse seitens der Hersteller eingestellt.
Ebenfalls anfangs der 1970er Jahre konnte die wirksame Teilstruktur der ACE-hemmenden Peptide BPP5a und Teprotid aufgeklärt werden. Anhand dieser Entdeckungen wurden neue nichtpeptidische ACE-Hemmer entwickelt. 1974 wurde erstmalig der ACE-Hemmer Captopril beschrieben, der Produkt einer großangelegten Wirkstoffsuche (Screening) der Pharmafirma Squibb war. 1981 wurde er als erster ACE-Hemmer in die Therapie eingeführt. Zwei Jahre später folgte mit Enalapril die Markteinführung eines zweiten ACE-Hemmers.
Aufgrund des großen therapeutischen und wirtschaftlichen Erfolges der Arzneistoffe Captopril und Enalapril wurden eine 2. Generation der ACE-Hemmer entwickelt, die seit Anfang der 1990er Jahre erhältlich sind (z.B. Lisinopril und Ramipril).
Ökonomische Bedeutung
Jeder fünfte Krankenversicherte in Deutschland und jeder zweite Patient über 55 Jahre erhält Arzneimittel zur Behandlung des Bluthochdrucks. Ca. 35% der Bluthochdruckpatienten werden mit einen ACE-Hemmer in Monotherapie und ca. 55% in Kombination mit einem weiteren blutdrucksenkenden Arzneimittel behandelt. Diese Zahl wird nur durch Betablocker (ca. 45% bzw. 65%) übertroffen.
In den USA wurde im Jahr 2001 114 Millionen Packungen ACE-Hemmer verschrieben. Das entspricht einem Gesamtumsatz von ca. 4,3 Milliarden US-Dollar. Den Hauptanteil daran trägt der ACE-Hemmer Lisinopril (ca. 47%), gefolgt von Enalapril (17%), Captopril und Ramipril (je 9%). Auf dem von Generika geprägten deutschen Markt dominiert hingegen der Arzneistoff Enalapril.
Alternativen
Neuere Substanzen (Losartan, Valsartan) hemmen nicht mehr das Angiotensin Converting Enzym, sondern wirken antagonistisch auf den Angiotensin-II-Rezeptor-1 Subtyp (AT1-Antagonisten, Sartane), so dass Nebenwirkungen möglicherweise seltener auftreten. AT1-Antagonisten sind aber derzeit noch erheblich teurer als ACE-Hemmer, so dass sie diese bislang noch nicht ersetzen konnten. Die bessere Verträglichkeit besteht darin, dass sie nicht auf das Bradykinin-System einwirken.
Vasopeptidaseinhibitoren wie Omapatrilat sind von den klassischen ACE-Hemmern abgeleitet und stehen derzeit kurz vor der Zulassung durch die Gesundheitsbehörden. Zusätzlich zur Hemmung des Angiotensin Converting Enzyms hemmen die Vasopeptidaseinhibitoren die neutrale Endopeptidase, ein Enzym, das für die Inaktivierung des blutgefäßrelaxierenden atrialen natriuretischen Peptids (ANP) verantwortlich ist.
Ein anderer, neuartiger Angriffspunkt ist die Inhibition des in der Niere gebildeten Enzyms Renin, das für die Synthese von Angiotensin I verantwortlich ist. Mit A-72517 ist ein selektiver Hemmer dieses Enzyms in der klinischen Erprobung.
Literatur
- Cusham D.W. & Ondetti M.A. (1991). History of the design of captopril and related inhibitors of angiotensin converting enzyme. Hypertension 17:589-592
- Ferreira S.H., Greene L.H., Alabaster V.A., Bakhle Y.S. & Vane J.R. (1970). Activity of various fractions of bradykinin potentiating factor against angiotensin I converting enzyme. Nature 225:379-380.
- Mutschler E.,Geisslinger G., Kroemer H.K. & Schäfer-Korting M. (2001). Therapie der Hypertonie. In: Mutschler E. (Hrsg.) Arzneimittelwirkungen. 8. Auflage. Wissenschaftliche Verlagsgesellschaft mbH Stuttgart. S.571-587.
- Nemec K. & Schubert-Zsilavecz M. (2003). Vom Teprotid zum Captopril - Rationales Desig von ACE-Hemmern. Pharmazie in unserer Zeit 32:11-15. ISSN 0048-3664