Sommelet-Hauser-Umlagerung
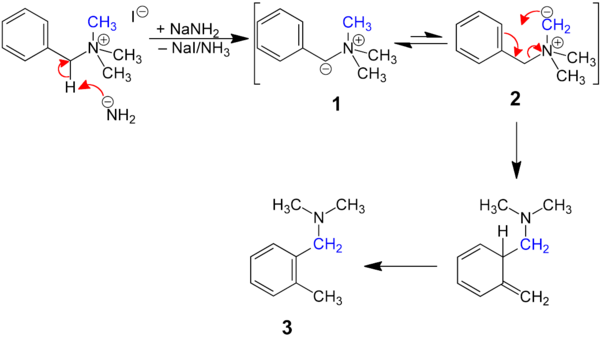
Die Sommelet–Hauser-Umlagerung, auch Sommelettsche Umlagerung, ist benannt nach Marcel Sommelet[1] und Charles R. Hauser[2] (1900–1970). Sie zählt in der organischen Chemie zu den Umlagerungsreaktionen. Dabei werden quartäre Benzyl-Ammoniumsalze in tertiäre Amine umgelagert:[3] Die Umlagerung erfolgt unter dem Einfluss von Natriumamid oder einem anderen Alkalimetallamid. Ausgehend von einem Trialkylbenzylammoniumsalz (z. B. Trimethylbenzylammoniumsalz) erhält man durch die Sommelet–Hauser-Umlagerung ein N-Dialkylbenzylamin mit einem Alkylsubstituenten (z. B. Methylsubstituenten) in der ortho-Position des Aromaten:[4]
Die Stevens-Umlagerung ist eine Konkurrenzreaktion der Sommelet–Hauser-Umlagerung.[5]
Reaktionsmechanismus
[Bearbeiten | Quelltext bearbeiten]Eines der Wasserstoffatome am Benzyl-Kohlenstoffatom ist unter basischen Bedingungen abspaltbar, wobei ein Ylid 1 resultiert. 1 steht im Gleichgewicht mit dem (weniger favorisierten!) isomeren Ylid 2, das sich nun umlagert ([2,3]-sigmatrope Umlagerung) unter Bildung eines ortho-Chinoids, das unter Rearomatisierung zum ortho-substituierten Amin 3 tautomerisiert.[6]
Anwendungsbeispiele
[Bearbeiten | Quelltext bearbeiten]Die Sommelet–Hauser-Umlagerung ist breit anwendbar und wurde in der Totalsynthese des antibiotisch wirksamen Naturstoffes Streptonigrin eingesetzt.[5]
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ M. Sommelet, Compt. Rend. 205, 56 (1937).
- ↑ Simon W. Kantor, Charles R. Hauser: Rearrangements of Benzyltrimethylammonium Ion and Related Quaternary Ammonium Ions by Sodium Amide Involving Migration into the Ring. In: J. Am. Chem. Soc. 1951, 73 (9), S. 4122–4131 (doi:10.1021/ja01153a022).
- ↑ Michael B. Smith: March's advanced organic chemistry. 7. Auflage. John Wiley & Sons, 2013, ISBN 978-0-470-46259-1, S. 798–799.
- ↑ Ernest L. Eliel, Samuel H. Wilen: Stereochemistry of Organic Compounds. John Wiles & Sons, 1994, ISBN 0-471-05446-1, S. 266–267.
- ↑ a b László Kürti, Barbara Czakó: Strategic Applications of Named Reactions in Organic Synthesis: Background and Detailed Mechanisms. Elsevier Academic Press, 2005, ISBN 0-12-429785-4, S. 422–423.
- ↑ V. K. Ahluwalia, R. K. Parashar: Organic Reaction Mechanisms. Alpha Science International, Harrow, U.K. 2005. Druck.