Snoutan
| Strukturformel | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|

| |||||||||||||
| Allgemeines | |||||||||||||
| Name | Snoutan | ||||||||||||
| Andere Namen |
Pentacyclo[4.4.0.02,4.03,8.05,7]decan (IUPAC) | ||||||||||||
| Summenformel | C10H12 | ||||||||||||
| Kurzbeschreibung |
weißer Feststoff[1] | ||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||
| |||||||||||||
| Eigenschaften | |||||||||||||
| Molare Masse | 132,2 g·mol−1 | ||||||||||||
| Aggregatzustand |
fest[1] | ||||||||||||
| Schmelzpunkt |
93,5 °C[1] | ||||||||||||
| Sicherheitshinweise | |||||||||||||
| |||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||||||||
Snoutan ist eine chemische Verbindung aus der Gruppe der gesättigten polycyclischen aliphatischen Kohlenwasserstoffe, bestehend aus Sechs-, Fünf- und Dreiringen. Die Verbindung gehört wie die Platonischen Kohlenwasserstoffe oder die Asterane zu den Käfigverbindungen.
Die Bezeichnung für die Verbindung wurde 1971 bei der Veröffentlichung der Synthese des ungesättigten Kohlenwasserstoffs Snouten durch Leo A. Paquette geprägt. Der Name leitet sich vom mittelalterlichen englischen Wort „snoute“ (deutsch „Schnauze“) ab und bezieht sich auf die Ähnlichkeit der Struktur dieses Moleküls mit der vorderen Verlängerung des Kopfes verschiedener Tiere, wie beispielsweise dem Krokodil. Der Name Snoutan für die gesättigte Stammverbindung wurde durch die zuständige Behörde genehmigt.[3]
Synthese
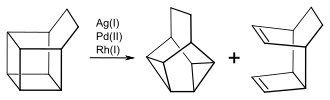
[Bearbeiten | Quelltext bearbeiten]Snoutan erhält man bei der mit Silberchlorat katalysierten Valenzisomerisierung von Basketan in Benzol.[1]
Mit anderen Übergangsmetallen als Katalysator erhält man als weiteres Produkt ein tricyclisches Dien:
Das Verhältnis der beiden Produkte hängt von dem Katalysator ab. So erhält man bei der Isomerisierung von Basketan mit [Rh(NOR)Cl]2 zu über 99 % das Dien, während mit PdCl2(PPh3)2 der Anteil von Snoutan bei 29,9 % liegt. Bei substituierten Basketanen beeinflussen die Substituenten die Produktverteilung. So isomerisiert beispielsweise 4,5-Dimethylbasketan mit PdCl2(PPh3)2 zu 100 % zu dem Dimethylsnoutan.[4]
Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Bei der Hydrierung von Snoutan über einem Palladium-Kohle-Katalysator in Methanol wird zunächst die Cyclopropanringbindung zwischen C2 und C4 gespalten. Die Weiterhydrierung des Dihydrosnoutan führt nicht durch die Spaltung der Bindung zwischen C5 und C7 zu dem symmetrischen C10H16-Kohlenwasserstoff Twistan, sondern durch Spaltung der Bindung zwischen C5 und C6 zu dem Isotwistan.[5]
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b c d Leo A. Paquette, Ronald S. Beckley, William B. Farnham: Silver(I) Ion Catalyzed Rearrangements of Strained σ Bonds. XXVII. Kinetic Analysis of the Silver(I)-Catalyzed 1,8-Bishomocubane-Snoutane Rearrangement. In: Journal of the American Chemical Society. Band 97, Nr. 5, März 1975, S. 1089, doi:10.1021/ja00838a024.
- ↑ Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- ↑ Leo A. Paquette, John C. Stowell: Silver(I) Ion Catalyzed Rearrangements of Strained σ Bonds. III. The Synthesis and Degenerate Thermal Valence Isomerization of Pentacyclo[3.3.2.02,4.03,7.06,8]dec-9-ene. In: Journal of the American Chemical Society. Band 93, Nr. 10, Mai 1971, S. 2459, doi:10.1021/ja00739a017.
- ↑ Leo A. Paquette, Roger A. Boggs, William B. Farnham, Ronald S. Beckley: Silver(I) Ion Catalyzed Rearrangements of Strained σ Bonds. XXIX. Influence of Structural Features on the Course of Transition Metal Catalyzed 1,8-Bishomocubane Rearrangements. In: Journal of the American Chemical Society. Band 97, Nr. 5, März 1975, S. 1112, doi:10.1021/ja00838a026.
- ↑ Hans Musso: Hydrogenolyse kleiner Kohlenstoffringe, II. Über die Hydrierung von Basketan- und Snoutanderivaten. In: Chemische Berichte. Band 108, Nr. 1, Januar 1975, S. 337, doi:10.1002/cber.19751080143.