Naphtholactam
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|

| |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Naphtholactam | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C11H7NO | ||||||||||||||||||
| Kurzbeschreibung |
schwachgelbes bis gelbes Kristallpulver[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 169,18 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Löslichkeit | |||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Toxikologische Daten | |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||||||||||||||
Naphtholactam ist ein Derivat des bicyclischen aromatischen Kohlenwasserstoffs Naphthalin, das in 1,8-Position mit einer Lactamfunktion überbrückt ist. Die auch häufig als Naphthostyril bezeichnete Substanz ist ein Molekülbaustein für gelbe bis violette Dispersionsfarbstoffe und Pigmente der Naphtholactam-Reihe und wegen seiner anellierten Indolstruktur Ausgangsstoff für pharmakologisch aktive Verbindungen.
Darstellung
[Bearbeiten | Quelltext bearbeiten]Auf der Suche nach neuen Grundgerüsten für stabile und brillante Pigmente geriet im ausgehenden 19. Jahrhundert auch Naphthalin als bicyclischer Aromat in den Fokus wissenschaftlichen Interesses. Allerdings erwies sich der Zugang zu dem funktionellen Naphthalinderivat Naphthostryril, ausgehend von 1-Nitronaphthalin-8-carbonsäure über 1-Aminonaphthalin-8-carbonsäure und deren Dehydratisierung,[3]
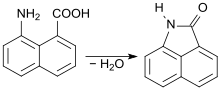
damals ebenso umständlich, aufwendig und unergiebig wie der Hofmann-Umlagerung von Naphthalimid mittels Natriumhypochlorit.[4]

Erst mit der leichten Zugänglichkeit von Acenaphthen aus Steinkohlenteer und daraus von Naphthalsäureanhydrid wurde Naphthalimid zu einer brauchbaren Ausgangsverbindung, aus der Naphthostyril in hoher Reinheit und akzeptablen Ausbeuten (73 %) erhalten werden konnte.[5]
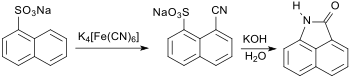
Auch die in fünfstufiger Synthese aus Naphthalin „technisch leicht zugängliche“ 8-Cyanonaphthalin-1-sulfonsäure[6], aus der im letzten Schritt durch Alkalischmelze Naphthostyril in über 80 % Ausbeute erhalten werden kann, eignet sich eher weniger als Ausgangsstoff für 1,8-Naphtholactam.
Aus dem wesentlich einfacher zugänglichen 1-Naphthylamin wird durch Umsetzung mit Phosgen 1-Naphthylisocyanat erhalten, das beim Erhitzen mit Aluminiumchlorid AlCl3 zu Naphthostyril cyclisiert.[7]

1,8-Naphtholacton (CAS-Nr. 5247-85-8) – aus Naphthalsäureanhydrid beim Erhitzen (> 300 °C) mit Kupfer(II)-oxid CuO[8] – und dessen anschließende Umsetzung mit Ammoniak NH3 unter Druck (150 °C) erzeugt Naphtholactam (91 % Ausbeute).[9]

Statt des von Fritz Ullmann beschriebenen Hofmann-Abbaus von Naphthalimid kann mit besseren Resultaten der Lossen-Abbau von Hydroxamsäurederivaten als Synthesevariante genutzt werden. Dazu wird das aus Naphthalsäureanhydrid und Hydroxylaminsulfat oder Hydroxylaminhydrochlorid erhältliche N-Hydroxynaphthalimid mit Benzolsulfochlorid[10] zum Benzolsulfonat bzw. mit 2,4-Dinitrochlorbenzol[11] zur entsprechenden Phenyoxyverbindung umgesetzt. Beim Erhitzen mit Natronlauge entsteht intermediär ein Isocyanat, das zu Naphtholactam cyclisiert.

Diese Syntheseroute verläuft über gute Ausbeuten beider Stufen (> 80 %), allerdings mit niedriger Atomökonomie wegen enormem Reaktandeneinsatz und hoher Salzfracht.
Eigenschaften
[Bearbeiten | Quelltext bearbeiten]1,8-Naphtholactam ist ein hellgelber kristalliner Feststoff, der in Wasser praktisch nicht, in Methanol aber gut löslich ist. Zur Reinigung kann die Verbindung in Essigsäure umkristallisiert oder in verdünnter Sodalösung unter Hydrolyse zu 1-Aminonaphthalin-8-carbonsäure gelöst und beim Erhitzen mit Salzsäure wieder als kristallines Naphthostyril ausgefällt werden.[12]
Anwendungen
[Bearbeiten | Quelltext bearbeiten]Naphtholactam als Baustein für Wirkstoffe
[Bearbeiten | Quelltext bearbeiten]Wegen seiner strukturellen Ähnlichkeit zu dem in vielen Natur- und Arzneistoffen präsenten Indol bzw. Oxindol wird Naphtholactam als Grundgerüst für pharmakologisch aktive Wirkstoffe bearbeitet, wie z. B. in Varianten für Sunitinib als antitumoral aktivem Tyrosinkinase-Inhibitor.[13]

Naphtolactamderivate wurden unlängst beschrieben, die als wirksame BET Inhibitoren mit entzündungshemmenden und cytostatischen Eigenschaften wirken.[14]
Verknüpfung der Benzo[cd]indol-2(1H)-on-Struktur mit Polyaminen liefert Naphtholactamkonjugate, die sich als Fluoreszenzmarker und antimetastatischer Wirkstoff eignen.[15]

Naphtholactam als Baustein für Farbstoffe und Pigmente
[Bearbeiten | Quelltext bearbeiten]Wesentliche Anwendung für Naphthostyril ist als Ausgangsstoff für Dispersionsfarbstoffe und Pigmente aus der Stoffklasse der Naphtholactam-Farbmittel, die ein breites Farbspektrum von gelb über orange und rot bis violett abdecken.
Bei der Reaktion von Barbitursäurederivaten, wie z. B. 1,3-Dibenzylbarbitursäure, mit Naphtholactam entsteht praktisch quantitativ ein gelber Farbstoff mit sehr guter Farbechtheit.[16]
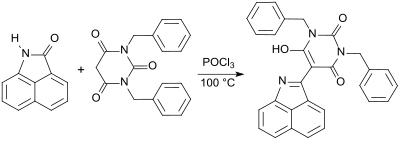
Substituenten im Naphtholactam- und im Barbitursäuremolekülteil erzeugen Dispersionsfarbstoffe mit gelben, orangefarbenen, roten und violetten Farbtönen.[17]
Eine Vielzahl von roten Dispersionsfarbstoffen werden bei der Reaktion von (substituiertem) Naphtholactam mit Kondensationsprodukten von (substituiertem) 1,2-Phenylendiamin mit dem Natriumsalz des Oxalessigsäurediethylesters erhalten.[18]

Der angegebene Farbstoff ist in Festsubstanz ziegelrot und löst sich in Dimethylformamid DMF mit blauroter Farbe. Dispersionsfarbstoffe aus Naphthostyril eignen sich wegen ihrer hohen Lichtstabilität und damit Farbechtheit für die dauerhafte Einfärbung von Kunststoffen und synthetischen Fasern, insbesondere aus Polyester und Polyamiden.
Größere Bedeutung hat das aus Naphtholactam über eine mehrstufige Synthese zugängliche brillantrote 4,10-Dibromanthanthron (Pigment Red 168) erlangt.

das wegen seiner exzellenten Farbstärke und Deckkraft, sowie Licht- und Wetterbeständigkeit in hochwertigen Industrie- und Autolacken, Latexfarben, wasserbasierten Lacken, Beschichtungen usw. Anwendung findet.
Literatur
[Bearbeiten | Quelltext bearbeiten]- Rami Ismael, Hansrudolf Schwander, Paul Hendrix: Fluorescent Dyes and Pigments. Wiley-VCH, Weinheim 2013, doi:10.1002/14356006.a11_279.pub2.
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b Eintrag zu Benzo[cd]indol-2(1H)-one bei TCI Europe, abgerufen am 20. Januar 2021.
- ↑ a b c d Datenblatt Benzo[cd]indol-2(1H)-one bei Sigma-Aldrich, abgerufen am 20. Januar 2021 (PDF).
- ↑ A.G. Eckstrand: Zur Kenntnis der Naphtoësäure. In: J. prakt. Chem. Band 38, Nr. 1, 1888, S. 139–185, doi:10.1002/prac.18880380113.
- ↑ Fritz Ullmann, Erwin Cassirer: Studien in der Acenaphthen-Reihe. In: Chem. Ber. Band 43, Nr. 1, 1910, S. 439–445, doi:10.1002/cber.19100430171.
- ↑ Patent DE3535482A1: Verfahren zur Herstellung von Naphthostyril. Angemeldet am 4. Oktober 1985, veröffentlicht am 9. April 1987, Anmelder: Hoechst AG, Erfinder: O. Arndt, T. Papenfuhs.
- ↑ Patent DE441225: Verfahren zur Darstellung von Naphthostyril beziehungsweise 1-Aminonaphthalin-8-carbonsäure. Angemeldet am 30. November 1924, veröffentlicht am 10. Februar 1927, Anmelder: I.G. Farbenindustrie AG, Erfinder: Richard Herz, F. Schulte.
- ↑ Patent US2628964: Preparation of naphthostyrils. Angemeldet am 7. April 1951, veröffentlicht am 17. Februar 1953, Anmelder: American Cyanamid Co., Erfinder: M. Scalera, W.B. Hardy, J.J. Leavitt.
- ↑ Patent DE3105485A1: Neues Verfahren zur Herstellung von Naphtholacton. Angemeldet am 14. Februar 1981, veröffentlicht am 19. August 1982, Anmelder: Rütgerswerke AG, Erfinder: J. Tabiersky, H. Pingen, M. Langenkamp.
- ↑ Patent US4515963: Process for producing 1,8-naphtholactam compounds. Angemeldet am 14. Januar 1983, veröffentlicht am 7. Mai 1985, Anmelder: Ciba Geigy AG, Erfinder: R. Begrich.
- ↑ Patent DE3524808A1: Verfahren zur Herstellung von N-Alkyl- bzw. N-Arylsulfonyloxynaphthalimiden. Angemeldet am 11. Juli 1985, veröffentlicht am 15. Januar 1987, Anmelder: Ciba Geigy AG, Erfinder: H. Schwander.
- ↑ G. Marzoni, M.D. Varney: An improved large-scale synthesis of benz[cd]indol-2(1H)-one and 5-methylbenz[cd]indol-2(1H)-one. In: Org. Process Res. Dev. Band 1, Nr. 1, 1997, S. 81–84, doi:10.1021/op960005+.
- ↑ Patent US2111756: Manufacture of naphthostyril and 8-amino-1-naphthoic acid. Angemeldet am 7. Juni 1934, veröffentlicht am 22. März 1938, Anmelder: A. Corbellini, Erfinder: A. Corbellini.
- ↑ A.A. Gryshchenko, K.V. Levchenko, V.G. Bdzhola, T.P. Ruban, L.L. Lukash, S.M. Yarmoluk: Design, synthesis and biological evaluation of naphthostyril derivatives as novel protein kinase FGFR1 inhibitors. In: J. Enzyme Inhib. Med. Chem. Band 30, Nr. 1, 2015, S. 126–132, doi:10.3109/14756366.2014.895718.
- ↑ X. Xue et al.: Discovery of Benzo[cd]indol-2(1H)-ones as Potent and Specific BET Bromodomain Inhibitors: Structure-Based Virtual Screening, Optimization, and Biological Evaluation. In: J. Med. Chem. Band 59, Nr. 4, 2016, S. 1565–1579, doi:10.1021/acs.jmedchem.5b01511.
- ↑ J. Li et al.: Discovery of the polyamine conjugate with benzo[cd]indol-2(1H)-one as a lysosome-targeted antimetastatic agent. In: J. Med. Chem. Band 61, Nr. 15, 2018, S. 6814–6829, doi:10.1021/acs.jmedchem.8b00694.
- ↑ Patent US3980651: Water-insoluble barbituric acid-substituted naphthalactam dyestuff. Angemeldet am 8. August 1974, veröffentlicht am 14. September 1976, Anmelder: Bayer AG, Erfinder: A. Brack.
- ↑ Patent US4009165: Naphtholactam dyes. Angemeldet am 5. Mai 1975, veröffentlicht am 22. Februar 1977, Anmelder: BASF AG, Erfinder: E. Schefczik.
- ↑ Patent US4056528: Disperse dyes. Angemeldet am 13. Februar 1976, veröffentlicht am 1. November 1977, Anmelder: Ciba-Geigy Corp., Erfinder: H. Schwander, K. Burdeska, C. Zickendraht.
