Criegee-Umlagerung
Die Criegee-Umlagerung, benannt nach dem deutschen Chemiker Rudolf Criegee (1902–1975), ist eine Namensreaktion aus dem Bereich der organischen Chemie und wurde 1945 erstmals erwähnt.[1]
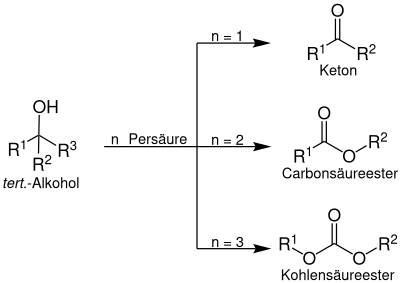
Bei der Criegee-Umlagerung handelt es sich um eine Methode zur Umlagerung des Peroxyesters eines tertiären Alkohols in Ketone, Ester und Carbonate. Die Reaktion erfolgt mittels einer Persäure. Die Criegee-Umlagerung ist dabei nicht mit der Baeyer-Villiger-Oxidation zu verwechseln, bei der Ketone mittels Persäure zu Estern umgesetzt werden.[2]
Übersichtsreaktion
[Bearbeiten | Quelltext bearbeiten]Ein tertiärer Alkohol wird mittels Persäure zu einem Peroxyester umgesetzt, welcher durch mehrfache Insertion von Sauerstoff zu einem Keton, einem Carbonsäureester oder zu einem Kohlensäureester umgesetzt werden kann:
Reaktionsmechanismus
[Bearbeiten | Quelltext bearbeiten]Der nachfolgend präsentierte Reaktionsmechanismus wird in der Literatur[2] beschrieben:
Erste Sauerstoff-Insertion
[Bearbeiten | Quelltext bearbeiten]Im ersten Schritt entsteht aus einem tertiären Alkohol 1 und einer Persäure 2, unter Abspaltung von Wasser, der Peroxyester 3.

Durch eine starke Polarisation der O-O-Bindung, kommt es zu einer heterolytischen Spaltung und die Zwischenstufen 4 und 5 entstehen.[3] Im folgenden Schritt kommt es zur ersten Sauerstoff-Insertion. Dabei wird an das Carbokation 5 zunächst Wasser angelagert. Durch Protonenumlagerung kommt es anschließend zur Abspaltung eines primären Alkohols und durch das Carboxylat-Ion 4 zur Abspaltung einer Carbonsäure. Das Produkt der Reaktion ist ein Keton 6.

Zweite Sauerstoff-Insertion
[Bearbeiten | Quelltext bearbeiten]Bei der zweiten Sauerstoff-Insertion, wird aus dem Carbokation 5 mit der Persäure 2 zunächst wieder ein Peroxyester gebildet.
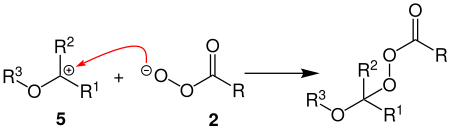
Durch erneute heterolytischen Spaltung der O-O-Bindung des Peroxyesters, wird das Carbokation 7 gebildet. Wie bei der ersten Sauerstoff-Insertion wird nachfolgend ein primärer Alkohol und eine Carbonsäure abgespalten, wobei nun ein Carbonsäureester 8 entsteht.

Dritte Sauerstoff-Insertion
[Bearbeiten | Quelltext bearbeiten]Die dritte Sauerstoff-Insertion verläuft nach dem gleichen Schema, wobei der Peroxyester aus dem Carbokation 7 gebildet wird.

Das Produkt der dritten Sauerstoff-Insertion ist ein Kohlensäureester 9.

Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ Rudolf Criegee: Ein neuer Weg in die Cyclodecanreihe In: Ber. Dtsch. Chem. Ges. 77, 1945, S. 722–726, doi:10.1002/cber.19450770912.
- ↑ a b Zerong Wang: Comprehensive Organic Name Reactions and Reagents, Wiley, 2009, ISBN 978-0-471-70450-8, S. 770–774.
- ↑ R. Criegee: Die Umlagerung der Dekalin‐peroxydester als Folge von kationischem Sauerstoff In: Justus Liebigs Ann. Chem. 560, 1948, S. 127–135, doi:10.1002/jlac.19485600106.