2,6-Diiodphenol
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|

| |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | 2,6-Diiodphenol | ||||||||||||||||||
| Summenformel | C6H4I2O | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 345,9 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||||||||||||||
2,6-Diiodphenol ist eine chemische Verbindung, die sowohl zu den Phenolen als auch zu den Halogenaromaten zählt.
Darstellung
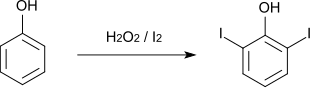
[Bearbeiten | Quelltext bearbeiten]2,6-Diiodphenol wurde erstmals 1883 von C. Schall aus Natriumphenolat und elementarem Iod hergestellt.[3] Der Nachweis, dass es sich bei dem von Schall erhaltenen Diiodphenol um das 2,6-Isomer handelte, wurde erst 1902 von M. P. Brenans erbracht.[4] Als Nebenprodukte entstehen bei dieser Reaktion 4-Iodphenol und 2,4,6-Triiodphenol. Eine weitere Synthesemöglichkeit ist die Reaktion von Phenol mit Iod in Wasserstoffperoxid, die in sehr guten Ausbeuten das gewünschte Produkt liefert.[5]
Derivate
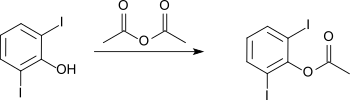
[Bearbeiten | Quelltext bearbeiten]Veresterung mit Essigsäureanhydrid liefert das Acetat, das bei 107 °C schmilzt.[1]
Der Methylether kann durch Methylierung mit Dimethylsulfat hergestellt werden und ist auch unter dem Trivialnamen 2,6-Diiodanisol bekannt. Sein Schmelzpunkt liegt bei 35 °C[4]. Die Schmelzpunkte weiterer Ether sind in untenstehender Tabelle gelistet.

| Ether des 2,6-Diiodphenols[4] | ||||
| Namen | 2,6-Diiodanisol 2,6-Diiodmethoxybenzol |
2,6-Diiodphenetol 2,6-Diiodethoxybenzol |
2,6-Diiodallyloxybenzol | 2,6-Diiodbenzyloxybenzol |
| Strukturformel | ||||
| Summenformel | C7H6I2O | C8H8I2O | C9H8I2O | C13H10I2O |
| Molare Masse | 359,9 g·mol−1 | 373,9 g·mol−1 | 385,9 g·mol−1 | 435,9 g·mol−1 |
| Beschreibung | farblose Prismen | |||
| Schmelzpunkt | 35 °C | 41–42 °C | 46 °C | 74,5 °C |
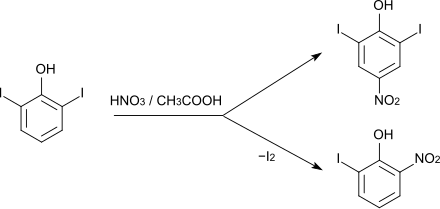
Die Nitrierung von 2,6-Diiodphenol mit Salpetersäure in Essigsäure ergibt ein Gemisch von 2,6-Diiod-4-nitrophenol (CAS-Nummer: 305-85-1, Schmelzpunkt 155–156 °C) und 2-Iod-6-nitrophenol (CAS-Nummer: 13073-26-2), wobei letzteres unter Freisetzung von elementarem Iod entsteht.[4]
Die Bromierung von 2,6-Diiodphenol mit elementarem Brom in Essigsäure liefert 4-Brom-2,6-diiodphenol, dessen Schmelzpunkt bei 128 °C liegt.[6]
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b Dictionary of organic compounds, S. 2499 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Für diesen Stoff liegt noch keine harmonisierte Einstufung vor. Wiedergegeben ist eine von einer Selbsteinstufung durch Inverkehrbringer abgeleitete Kennzeichnung von 2,6-diiodophenol im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 15. Mai 2023.
- ↑ C. Schall: Einwirkung von Jod auf Phenolnatrium, in: Ber. d. dt. chem. Ges., 1883, 16 (2), S. 1897–1902; doi:10.1002/cber.18830160272.
- ↑ a b c d M. P. Brenans: Sur quelques phénols iodés, in: C. R. Hebd. Séances Acad. Sci., 1902, 134, S. 357.
- ↑ Rafael D. C. Gallo, Karimi S. Gebara, Rozanna M. Muzzi, Cristiano Raminelli: Efficient and selective iodination of phenols promoted by iodine and hydrogen peroxide in water, in: J. Braz. Chem. Soc., 2010, 21 (4); doi:10.1590/S0103-50532010000400026.
- ↑ P. Brenans, K. Yeu: Phénols bromodiiodés, composés trihalogénés symétriques in C. R. Hebd. Séances Acad. Sci., 1930, 190, S. 1560–1561; Volltext.
