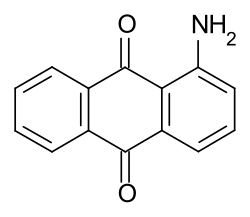
1-Aminoanthrachinon
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | 1-Aminoanthrachinon | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | C14H9NO2 | |||||||||||||||
| Kurzbeschreibung |
dunkelbrauner Feststoff[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 223,23 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest[1] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Siedepunkt |
>300 °C[2] | |||||||||||||||
| Dampfdruck | ||||||||||||||||
| Löslichkeit |
| |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Toxikologische Daten | ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||||||||
1-Aminoanthrachinon ist eine chemische Verbindung aus der Gruppe der Anthrachinonderivate.
Gewinnung und Darstellung
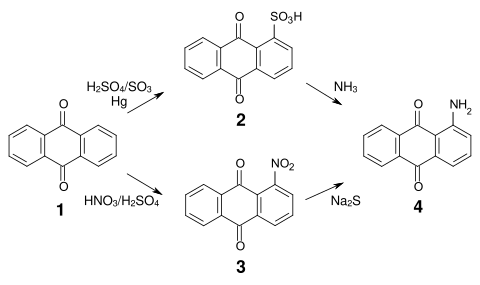
[Bearbeiten | Quelltext bearbeiten]Die wichtigsten Herstellungsmethoden für 1-Aminoanthrachinon sind die Umsetzung der Anthrachinonsulfonsäure (2) mit Ammoniak, bzw. die Reduktion von 1-Nitroanthrachinon (3), welches durch Nitrierung von Anthrachinon (1) zugänglich ist.[4][5]
Die Reduktion von Nitroanthrachinon wird beispielsweise mit Natriumsulfid oder Natriumhydrogensulfid durchgeführt. Alternativ zur Reduktion ist auch ein Austausch der Nitrogruppe gegen die Aminogruppe möglich, wobei diese Reaktion hauptsächlich bei der Herstellung sekundärer Amine verwendet wird.[6]
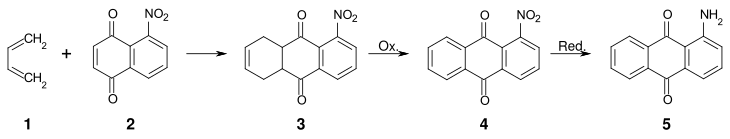
Eine alternative Methode zur Darstellung von 1-Aminoanthrachinon unter Aufbau des Anthrachinongerüsts geht von 5-Nitronaphthochinon aus.
Durch Umsetzung von 1,3-Butadien (1) mit 5-Nitronaphthochinon (2) im Sinne einer Diels-Alder-Reaktion erhält man 5-Nitro-1,4,4a,9a-tetrahydroanthrachinon (3). Durch Oxidation wird 3 in das 1-Nitroanthrachinon (4) überführt, das anschließend zum 1-Aminoanthrachinon (5) reduziert wird.[7]
Eigenschaften
[Bearbeiten | Quelltext bearbeiten]1-Aminoanthrachinon ist ein brennbarer, schwer entzündbarer, kristalliner, dunkelbrauner Feststoff, der praktisch unlöslich in Wasser ist.[1]
Verwendung
[Bearbeiten | Quelltext bearbeiten]1-Aminoanthrachinon wird als Zwischenprodukt zur Herstellung von Anthrachinonfarbstoffen und Arzneistoffen verwendet.[2]
Ein wichtiges Farbstoffzwischenprodukt ist die Bromaminsäure (1-Amino-4-bromanthrachinon-2-sulfonsäure) (6), die ausgehend von 1-Aminoanthrachinon (4), über eine Sulfonierung mit Chlorsulfonsäure oder Oleum und anschließender Bromierung zugänglich ist.[8]
Weblinks
[Bearbeiten | Quelltext bearbeiten]- Berufsgenossenschaft Rohstoffe und chemische Industrie: TOXIKOLOGISCHE BEWERTUNGEN in Langfassung (05/2002) 1-Aminoanthrachinon, abgerufen am 16. Mai 2019
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b c d e f g Eintrag zu 1-Aminoanthrachinon in der GESTIS-Stoffdatenbank des IFA, abgerufen am 16. Mai 2019. (JavaScript erforderlich)
- ↑ a b c d e OECD: Screening Information Dataset (SIDS) Initial Assessment Report (SIAR) für Anthraquinone, 1-amino-, abgerufen am 16. Mai 2019.
- ↑ Datenblatt 1-Aminoanthraquinone, 97% bei Alfa Aesar, abgerufen am 16. Mai 2019 (Seite nicht mehr abrufbar).
- ↑ Eintrag zu Aminoanthrachinone. In: Römpp Online. Georg Thieme Verlag, abgerufen am 21. Mai 2019.
- ↑ Willy Herbst, Klaus Hunger: Industrial Organic Pigments Production, Properties, Applications. John Wiley & Sons, 2006, ISBN 978-3-527-60406-7, S. 501 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Hans-Samuel Bien, Klaus Wunderlich: Anthrachinon-Farbstoffe und -Zwischenprodukte. In: Ullmanns Encyklopädie der technischen Chemie. 4. Auflage. Band 7. Verlag Chemie, Weinheim 1974, ISBN 3-527-20000-2, S. 585 ff.
- ↑ Patentanmeldung DE2539631: Verfahren zur Herstellung von hochreinem 5-Nitro-1,4,4A,9A-tetrahydroanthrachinon. Angemeldet am 5. September 1975, veröffentlicht am 18. März 1976, Anmelder: Mitsui Toatsu Chemicals, Erfinder: Torisu Yasuyoshi, Kaba Seishichiro, Mukai Ken.
- ↑ E. N. Abrahart: Dyes and their Intermediates. 2. Auflage. Edward Arnold (Publishers) Ltd., London 1977, ISBN 0-7131-2580-2, S. 41–42.