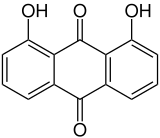
1,8-Dihydroxyanthrachinon
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Name | 1,8-Dihydroxyanthrachinon | |||||||||||||||||||||
| Andere Namen |
| |||||||||||||||||||||
| Summenformel | C14H8O4 | |||||||||||||||||||||
| Kurzbeschreibung |
oranges geruchloses Pulver[1] | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||||||||
| ATC-Code | ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 240,21 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand |
fest[1] | |||||||||||||||||||||
| Schmelzpunkt |
190–193 °C[1] | |||||||||||||||||||||
| Löslichkeit |
| |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Toxikologische Daten | ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||||||||||||||
1,8-Dihydroxyanthrachinon, auch unter dem Namen Chrysazin oder Danthron bekannt, ist eine organische Verbindung aus der Stoffgruppe der Anthrachinone (genauer der Dihydroxyanthrachinone).
Vorkommen
[Bearbeiten | Quelltext bearbeiten]
Chrysazin kommt neben anderen Anthrachinonen glycosidisch gebunden in den Wurzeln des Färberkrapps, sowie in vielen Aloearten (besonders in echter Aloe) als Aloeemodin vor.[4][5][6]
Darstellung
[Bearbeiten | Quelltext bearbeiten]Chrysazin kann durch Photooxidation von Dithranol mit angeregtem Sauerstoff gewonnen werden. Der folgende Reaktionsmechanismus wurde durch das Benutzen des Sauerstoff-Isotops 18O (blau dargestellt) bewiesen.[7]

Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Das 1,8-Dihydroxyanthrachinon lässt sich durch das Vermischen von Ether, Magnesiumsulfat und Ammoniak nachweisen, denn die Etherphase, sowie die wässrige Phase färben sich bei Anwesenheit rot.[8]
Verwendung
[Bearbeiten | Quelltext bearbeiten]Die Derivate und Glycoside, welche in den Aloearten vorkommen, haben eine abführende Wirkung und werden deswegen als Abführmittel verwendet.[9]
Biologische Bedeutung
[Bearbeiten | Quelltext bearbeiten]Chrysazin wird in einigen Ländern als krebserregend eingestuft. Untersuchungen ergaben sowohl Hinweise auf eine DNA-schädigende Wirkungen in Bakterien- und Zellkulturmodellen als auch auf eine kanzerogene Wirkung in Nagerstudien.[10]
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b c d e f Eintrag zu 1,8-Dihydroxyanthrachinon in der GESTIS-Stoffdatenbank des IFA, abgerufen am 20. Januar 2022. (JavaScript erforderlich)
- ↑ Eintrag zu Dantron. In: Römpp Online. Georg Thieme Verlag, abgerufen am 21. Juni 2018.
- ↑ a b Eintrag zu Danthron in der ChemIDplus-Datenbank der United States National Library of Medicine (NLM), abgerufen am 13. Juli 2017. (Seite nicht mehr abrufbar)
- ↑ Goverdina C. H. Derksen, Harm A. G. Niederländer, Teris A. van Beek: Analysis of anthraquinones in Rubia tinctorum L. by liquid chromatography coupled with diode-array UV and mass spectrometric detection. In: Journal of Chromatography A. 978 (1–2), 2002, S. 119–127, doi:10.1016/S0021-9673(02)01412-7.
- ↑ Berhanu M. Abegaz, B. T. Ngadjui, Merhatibeb Bezabih, L. K. Mdee: Novel natural products from marketed plants of eastern and southern Africa. In: Pure and Applied Chemistry. 71, 1999, doi:10.1351/pac199971060919.
- ↑ Maher Kammoun, Sonia Miladi, Yassine Ali, Mohamed Damak, Youssef Gargouri, Sofiane Bezzine: In vitro study of the PLA2 inhibition and antioxidant activities of Aloe vera leaf skin extracts. In: Lipids in Health and Disease. 10, 2011, S. 30, doi:10.1186/1476-511X-10-30.
- ↑ Müller, K., Mayer, K.K. und Wiegrebe, Wolfgang: 1O2-Oxidation of Dithranol to Chrysazin. In: Archiv der Pharmazie. 319, 1986, S. 1009–1018 urn:nbn:de:bvb:355-epub-156619
- ↑ Wolfgang Schneider: Über einige analytisch verwertbare Metallnachweise (Lithium, Magnesium, Aluminium) mit Hilfe von Istizin. In: Archiv der Pharmazie. 283, 1950, S. 248–253, doi:10.1002/ardp.19502830405.
- ↑ Final community herbal monograph on Aloe barbadensis Miller and on Aloe (various species, mainly Aloe ferox Miller and its hybrids) (PDF; 312 kB) Ausschuss für pflanzliche Arzneimittel der Europäischen Arzneimittelagentur, 26. Oktober 2006.
- ↑ NTP Report on 1996 Background Document for Danthron Carcinogens. (PDF) Abgerufen am 17. Juli 2017.

