Urethan
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
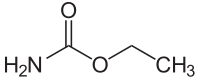
| ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Name | Urethan | |||||||||||||||||||||
| Andere Namen |
| |||||||||||||||||||||
| Summenformel | C3H7NO2 | |||||||||||||||||||||
| Kurzbeschreibung |
farb- und geruchlose Kristalle[1] | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 89,09 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||||||||
| Dichte | ||||||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||||
| Siedepunkt |
185 °C[1] | |||||||||||||||||||||
| Löslichkeit |
| |||||||||||||||||||||
| Brechungsindex |
1,4144 (51 °C)[3] | |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Thermodynamische Eigenschaften | ||||||||||||||||||||||
| ΔHf0 |
−517,1 kJ/mol[5] | |||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). Brechungsindex: Na-D-Linie, 20 °C | ||||||||||||||||||||||
Urethan (C3H7NO2) gehört zur chemischen Stoffgruppe der Carbamate.
Allgemein
[Bearbeiten | Quelltext bearbeiten]Urethan ist nicht, wie der Name es vermuten lässt, das Monomer von Polyurethan. Vielmehr besitzt Urethan die gleiche funktionelle Gruppe wie Polyurethan, nämlich die Urethan-Gruppe (–NH–CO–O–), die im Polyurethan in hoher Anzahl vorhanden ist. Urethan entsteht formal bei der Reaktion von Isocyansäure (HN=C=O) mit z. B. Ethanol oder anderen Alkoholen. Die Verbindungsklasse der Urethane bezeichnet also auch eine Stoffklasse, die die oben genannte funktionelle Gruppe enthält, nicht nur das Urethan, das eine Ethylgruppe (Ethylcarbamat) trägt. Analog erfolgt die Reaktion beim Polyurethan zwischen Di-, Tri oder Polyisocyanaten und mehrwertigen Alkoholen.
Gewinnung und Darstellung
[Bearbeiten | Quelltext bearbeiten]Urethan kann durch die Einwirkung von Ammoniak auf Diethylcarbonat oder durch gemeinsames Aufheizen von Harnstoffnitrat mit Ethanol hergestellt werden. Des Weiteren kann es auch durch Erhitzen (100 °C) äquimolarer Mengen Harnstoff und Ethanol bei Anwesenheit katalytisch wirkender konzentrierter Schwefelsäure erzeugt werden.
Vorkommen
[Bearbeiten | Quelltext bearbeiten]Urethan ist ein natürlicher Bestandteil einiger Lebensmittel, beispielsweise kommt es in Brot, Wein und fermentierten Getränken vor. Bei unsachgemäßer Herstellung kann Urethan insbesondere in Bränden aus Steinobst (Kirschwasser, Zwetschgenwasser, Mirabellenbrand) in höheren Konzentrationen vorkommen. Es ist als karzinogene (krebserregende) Verbindung bekannt. In der Schweiz gibt es seit 2003 eine Obergrenze von 1 mg/l in Spirituosen.
Verwendung
[Bearbeiten | Quelltext bearbeiten]Vor 1970 wurde es als Arzneimittel zur Behandlung von Leukämien und Varizen eingesetzt. In der tierexperimentellen Forschung dient es als langwirkendes Injektionsnarkotikum. Das ebenfalls intravenös verabreichte Narkotikum Hedonal war ein 1899 von Heinrich Dreser synthetisierter Urethanabkömmling und wurde um 1908 vor allem im russischen Raum, etwa von Nicholas P. Krakow[6][7] verwendet.
Sicherheitshinweise
[Bearbeiten | Quelltext bearbeiten]Urethan schädigt die Blutbildungsorgane, Leber und das Zentrale Nervensystem. Die Internationale Agentur für Krebsforschung hat Urethan in die Kategorie 2A („wahrscheinlich krebserzeugend für den Menschen“) eingestuft.[8]
Literatur
[Bearbeiten | Quelltext bearbeiten]- M. Rupp: Ethylcarbamat - wie gefährlich ist es wirklich? Toxikologische Bewertung. In: Kleinbrennerei. Heft 6, Band 3, 2005.
Weblinks
[Bearbeiten | Quelltext bearbeiten]- CVUA Karlsruhe: neue und sichere Methode zur Bestimmung von Ethylcarbamat in Steinobstbränden
- Informationen der Chemischen und Veterinäruntersuchungsämter Baden-Württembergs über Ethylcarbamat
- Kleinbrennerei: Ethylcarbamat (EC): Fragebögen ausgewertet
- Ethylcarbamatin Steinobstbränden - Entstehung und Vermeidung. (pdf) Chemisches und Veterinäruntersuchungsamt Karlsruhe, 11. Februar 2003, abgerufen am 20. Februar 2021.
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b c d e f g Eintrag zu Ethylcarbamat in der GESTIS-Stoffdatenbank des IFA, abgerufen am 8. Januar 2021. (JavaScript erforderlich)
- ↑ Eintrag zu Urethan. In: Römpp Online. Georg Thieme Verlag, abgerufen am 10. März 2014.
- ↑ David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press / Taylor and Francis, Boca Raton FL, Physical Constants of Organic Compounds, S. 3-240.
- ↑ Eintrag zu Urethane im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. Februar 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- ↑ David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press / Taylor and Francis, Boca Raton FL, Standard Thermodynamic Properties of Chemical Substances, S. 5-24.
- ↑ N. P. Krakow: Über die Hedonal-Chloroformnarkose. In: Archiv für experimentelle Pathologie und Pharmakologie. Supplement 317, 1908.
- ↑ H. Orth, I. Kis: Schmerzbekämpfung und Narkose. In: Franz Xaver Sailer, Friedrich Wilhelm Gierhake (Hrsg.): Chirurgie historisch gesehen. Anfang – Entwicklung – Differenzierung. Dustri-Verlag, Deisenhofen bei München 1973, ISBN 3-87185-021-7, S. 1–32, hier: S. 15 und 25.
- ↑ D. W. Lachenmeier, M. C. Lima, I. C. Nóbrega, J. A. Pereira, F. Kerr-Corrêa, F. Kanteres, J. Rehm: Cancer risk assessment of ethyl carbamate in alcoholic beverages from Brazil with special consideration to the spirits cachaça and tiquira. In: BMC Cancer. Band 10, Juni 2010, S. 266, doi:10.1186/1471-2407-10-266, PMID 20529350, PMC 2892455 (freier Volltext) (Review).

