„Phosphoglyceratmutase“ – Versionsunterschied
| [gesichtete Version] | [gesichtete Version] |
Unterscheidung zwischen Cofaktor-abhängigen und -unabhängigen Formen eingefügt. Die Anzeige der zusätzlichen EC-Nummer in der Infobox erfolgt nicht korrekt, ich schaffe es aber nicht, das zu korrigieren. Wenn da jemand helfen kann... |
K Vorlagen-/Parameter-Fix |
||
| Zeile 38: | Zeile 38: | ||
}} |
}} |
||
'''Phosphoglyceratmutasen (PGM oder PGAM)''' sind [[Enzym]]e, die die [[Umlagerung]] der [[Phosphat]]gruppe in [[Phosphoglycerat]] von 2- auf 3-Position und umgekehrt [[Katalyse|katalysieren]]. Diese Reaktion ist ein Teilschritt in der [[Glycolyse]], der Verwertung von [[Kohlenhydrate]]n im [[Stoffwechsel]] aller Lebewesen, die in jeder [[Zelle (Biologie)|Zelle]] stattfindet. Es wird zwischen [[Cofaktor (Biochemie)|Cofaktor]]-abhängigen (dPGM, EC |
'''Phosphoglyceratmutasen (PGM oder PGAM)''' sind [[Enzym]]e, die die [[Umlagerung]] der [[Phosphat]]gruppe in [[Phosphoglycerat]] von 2- auf 3-Position und umgekehrt [[Katalyse|katalysieren]]. Diese Reaktion ist ein Teilschritt in der [[Glycolyse]], der Verwertung von [[Kohlenhydrate]]n im [[Stoffwechsel]] aller Lebewesen, die in jeder [[Zelle (Biologie)|Zelle]] stattfindet. Es wird zwischen [[Cofaktor (Biochemie)|Cofaktor]]-abhängigen (dPGM, {{EC|5.4.2.11}}) und Cofaktor-unabhängigen (iPGM, {{EC|5.4.2.12}}) Enzymen unterschieden. Erstere benötigen [[2,3-Diphosphoglycerat]] als Kofaktor und finden sich in allen Wirbeltieren, einigen Wirbellosen, Pilzen und Bakterien. Zweitere sind in allen Pflanzen und Algen sowie einigen Wirbellosen, Pilzen und Bakterien verbreitet.<ref>{{Literatur |Autor=Mark J Jedrzejas |Titel=Structure, function, and evolution of phosphoglycerate mutases: comparison with fructose-2,6-bisphosphatase, acid phosphatase, and alkaline phosphatase |Sammelwerk=Progress in Biophysics and Molecular Biology |Band=73 |Nummer=2-4 |Datum=2000-02 |DOI=10.1016/S0079-6107(00)00007-9 |Seiten=263–287 |Online=https://linkinghub.elsevier.com/retrieve/pii/S0079610700000079 |Abruf=2023-04-03}}</ref> Mit den [[Säugetiere]]n haben sich durch Kopie zusätzliche [[Allel]]e des PGAM1-[[Gen]]s gebildet, die PGAM2, PGAM4 und PGAM5 genannt werden. PGAM2 wird nur in den Muskeln produziert. [[Mutation]]en am PGAM2-Gen führen zu einer Form der [[Muskeldystrophie]]. |
||
== Katalysierte Reaktion == |
== Katalysierte Reaktion == |
||
| Zeile 51: | Zeile 51: | ||
: <math>\mathrm{\text{Enz-His} + \text{2,3-Bisphosphoglycerat} \rightleftharpoons }</math> <math>\mathrm{\text{Enz-His-Phosphat} + \text{2-Phosphoglycerat}}</math> |
: <math>\mathrm{\text{Enz-His} + \text{2,3-Bisphosphoglycerat} \rightleftharpoons }</math> <math>\mathrm{\text{Enz-His-Phosphat} + \text{2-Phosphoglycerat}}</math> |
||
Das Enzym benötigt katalytische Mengen an 2,3-Bisphosphoglycerat, um den Histidinrest im aktiven Zentrum in phosphorylierter Form zu halten.<ref>{{Literatur| Autor = Jeremy M. Berg, John L. Tymoczko, Lubert Stryer, Gregory J. Gatto jr.| Titel = Stryer Biochemie| Verlag = Springer-Verlag| Datum = 2014| Seiten = 467| ISBN = 978-3-8274-2988-9| Online = {{Google Buch | BuchID = 827dBgAAQBAJ |
Das Enzym benötigt katalytische Mengen an 2,3-Bisphosphoglycerat, um den Histidinrest im aktiven Zentrum in phosphorylierter Form zu halten.<ref>{{Literatur| Autor = Jeremy M. Berg, John L. Tymoczko, Lubert Stryer, Gregory J. Gatto jr.| Titel = Stryer Biochemie| Verlag = Springer-Verlag| Datum = 2014| Seiten = 467| ISBN = 978-3-8274-2988-9| Online = {{Google Buch | BuchID = 827dBgAAQBAJ }}}}</ref> |
||
== Weitere Funktionen == |
== Weitere Funktionen == |
||
Aktuelle Version vom 19. April 2024, 18:05 Uhr
| Phosphoglyceratmutase | ||
|---|---|---|

| ||
| Phosphoglyceratmutase 1 (B type) dimer (Mensch) nach PDB 1YFK | ||
| Eigenschaften des menschlichen Proteins | ||
| Masse/Länge Primärstruktur | 253/252/254/270 Aminosäuren | |
| Sekundär- bis Quartärstruktur | Homodimer | |
| Bezeichner | ||
| Gen-Namen | PGAM1 ; PGAM2; PGAM4; PGAM5 | |
| Enzymklassifikationen | ||
| EC, Kategorie | 5.4.2.11, Isomerase | |
| Reaktionsart | Umlagerung | |
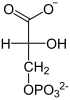
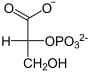
| Substrat | 2-Phosphoglycerat | |
| Produkte | 3-Phosphoglycerat
5.4.2.12 | |
| Vorkommen | ||
| Übergeordnetes Taxon | Lebewesen | |
Phosphoglyceratmutasen (PGM oder PGAM) sind Enzyme, die die Umlagerung der Phosphatgruppe in Phosphoglycerat von 2- auf 3-Position und umgekehrt katalysieren. Diese Reaktion ist ein Teilschritt in der Glycolyse, der Verwertung von Kohlenhydraten im Stoffwechsel aller Lebewesen, die in jeder Zelle stattfindet. Es wird zwischen Cofaktor-abhängigen (dPGM, EC 5.4.2.11) und Cofaktor-unabhängigen (iPGM, EC 5.4.2.12) Enzymen unterschieden. Erstere benötigen 2,3-Diphosphoglycerat als Kofaktor und finden sich in allen Wirbeltieren, einigen Wirbellosen, Pilzen und Bakterien. Zweitere sind in allen Pflanzen und Algen sowie einigen Wirbellosen, Pilzen und Bakterien verbreitet.[1] Mit den Säugetieren haben sich durch Kopie zusätzliche Allele des PGAM1-Gens gebildet, die PGAM2, PGAM4 und PGAM5 genannt werden. PGAM2 wird nur in den Muskeln produziert. Mutationen am PGAM2-Gen führen zu einer Form der Muskeldystrophie.
Katalysierte Reaktion[Bearbeiten | Quelltext bearbeiten]
2-Phosphoglycerat wird umgelagert zu 3-Phosphoglycerat und umgekehrt. Bei der Cofaktor-abhängigen Form erfolgt die Katalyse durch zwischenzeitliche Bildung eines Phosphohistidin-Restes in der PGAM. Dabei ist zu beachten, dass ein zusätzlicher Phosphatrest an C2 angelagert wird und somit das Zwischenprodukt 2,3-BPG entsteht.
Erst danach wird der Phosphatrest an C3 entfernt und die Mutase erhält die Phosphorylgruppe zurück, um den Phosphohistidin-Rest zu regenerieren.
Das Enzym benötigt katalytische Mengen an 2,3-Bisphosphoglycerat, um den Histidinrest im aktiven Zentrum in phosphorylierter Form zu halten.[2]
Weitere Funktionen[Bearbeiten | Quelltext bearbeiten]
Die PGAM-Isoformen haben zusätzlich schwache Aktivität als Bisphosphoglyceratmutase (EC 5.4.2.4) und als Biphosphoglycerat-Phosphatase (EC 3.1.3.13).
PGAM1 wird in Krebszellen im Übermaß produziert. PGAM1 bindet in vitro am Kern von Hepatitis-C-Virus. Patienten mit autoimmuner Hepatitis erzeugen vermehrt PGAM1-Antikörper.[3][4][5]
PGAM5 wird an die Außenmembran von Mitochondrien transportiert und bindet dort Keap1 und Nrf2.[6]
Weblinks[Bearbeiten | Quelltext bearbeiten]
Einzelnachweise[Bearbeiten | Quelltext bearbeiten]
- ↑ Mark J Jedrzejas: Structure, function, and evolution of phosphoglycerate mutases: comparison with fructose-2,6-bisphosphatase, acid phosphatase, and alkaline phosphatase. In: Progress in Biophysics and Molecular Biology. Band 73, Nr. 2-4, Februar 2000, S. 263–287, doi:10.1016/S0079-6107(00)00007-9 (elsevier.com [abgerufen am 3. April 2023]).
- ↑ Jeremy M. Berg, John L. Tymoczko, Lubert Stryer, Gregory J. Gatto jr.: Stryer Biochemie. Springer-Verlag, 2014, ISBN 978-3-8274-2988-9, S. 467 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ F. Lu et al.: Serum proteomic-based analysis for the identification of a potential serological marker for autoimmune hepatitis. Biochem Biophys Res Commun. 367/2/2008:284-90. PMID 18154727
- ↑ H. X. Su et al.: Screening cellular proteins binding to the core region of hepatitis C virus RNA genome with digoxin-labeled nucleic acids. Intervirology. 50/4/2007:303-9. PMID 17622790
- ↑ L. J. Huang et al.: Proteomic analysis of secreted proteins of non-small cell lung cancer. Ai Zheng. 25/11/2006:1361-7. PMID 17094902
- ↑ S. C. Lo und M. Hannink: PGAM5 tethers a ternary complex containing Keap1 and Nrf2 to mitochondria. Exp Cell Res. 314/8/2008:1789-803. PMID 18387606